TABLA CUANTICA
¿Qué es la tabla Cuántica?
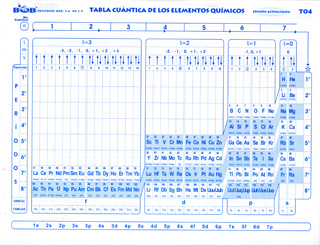
Esta tabla sirve para deducir los números cuánticos están clasificados en 4 bloques según la posición de la electrodiferencial y los bloques son: S, D, P y F.
Los elementos se encuentran también en 3 tipos que se indica en la parte inferior de las clases:
El bloque S y P se le llama elementos representativos y en una tabla periódica será el grupo o Familia A.
Los bloques estarán representados por el grupo I y II respectivamente.
Bloque /e elemento
Estructura de la Tabla Cuántica.
En esta tabla sola hay una igualdad sobre la tabla Periódica que hay periodos, pero en esta tabla existen una serie de subniveles o clases se encuentran en la parte inferior de la tabla y son S, P, D, F y significan:
Después encontramos otra serie de números cuánticos que se encuentran en la parte superior de la tabla y son:
La n: principal
Otro renglón que forma la tabla es el número de electrones que forma el elemento.
HISTORIA DE LA TABLA
Durante el siglo XIX, un científico ruso llamado Mendeleiev, gran estudiante de alkimia, recopiló la mayoría de los elementos puros conocidos hasta el momento y los ordenó en una tabla .
Esta se llamó tabla periódica de los elementos. Periódica por q ue cada elemento está formado por órbitas escalonadas, que responden a determinados períodos de clasificación. DIMITRI IVANOVICH MENDELEIEV ABRIR TABLA CONVENCIONAL
Cuando Mendeleiev presentó su tabla, explicó que aún faltaban elementos por descubrirse; es decir, él dibujó una tabla con 92 casilleros, pero no todos estaban llenos. Los casilleros vacíos correspondían a elementos que aún no se habían descubierto, y sin embargo debían existir. A medida que pasó el tiempo, los científicos han descubierto los elementos faltantes, hay 92 elementos naturales, el primero es el hidrógeno, y el último es el uranio. También se consideran naturales el 93 y 94, neptunio y plutonio respectivamente.
Los elementos 108, 109 y 110 duran milésimas de segundo, es decir, se desintegran apenas son purificados y aislados en el laboratorio. Los últimos informes que tengo, a fines del 2003 es que ya se ha logrado transmutar en un ciclotrón los elementos Nº 116 y 118. La tabla convencional agrupa a todos los elementos conocidos, incluso los transuránicos, como un todo, como un orden armónico y lógico que implica la existencia de un total de mas de 105 elementos conocidos, y sugiere que existen espacios disponibles para otros elementos que tal vez lleguen a conocerse.
La tabla convencional tiene forma rectangular, con algunos elementos agrupados en bloques fuera del rectángulo principal, tal como se observa en la Fig. 1. Sin embargo, el punto de vista de los antiguos alkimistas era muy diferente en cuanto al orden de los elementos.
Ellos decían que debería haber un orden natural y matemático tal como el que rige el crecimiento de los cristales. Además ese orden debe ser estudiado desde el principio absoluto, desde el primer acto de la creación al que ahora llamamos Big Bang.
Mecánica cuántica
La mecánica cuántica es una de las ramas principales de la física, y uno de los más grandes avances del siglo XX para el conocimiento humano; es la que explica el comportamiento de la materia y de la energía. Su aplicación ha hecho posible el descubrimiento y desarrollo de muchas tecnologías, como por ejemplo los transistores, componentes masivamente utilizados en prácticamente cualquier aparato que tenga alguna parte funcional electrónica. La mecánica cuántica describe, en su visión más ortodoxa, cómo cualquier sistema físico, y por lo tanto todo el universo, existe en una diversa y variada multiplicidad de estados, los cuales habiendo sido organizados matemáticamente por los físicos, son denominados autoestados de vector y valor propio. De esta forma la mecánica cuántica puede explicar y revelar la existencia del átomo y los misterios de la estructura atómica tal como hoy son entendidos; fenómenos que la física clásica, o más propiamente la mecánica clásica, no puede explicar debidamente.
En pocas palabras, en 1900 el físico alemán Max Planck introdujo la idea de que la energía estaba cuantizada, con el fin de derivar una fórmula para la dependencia de la frecuencia observada con la energía emitida por un cuerpo negro. En 1905, Einstein explicó el efecto fotoeléctrico por un postulado sobre que luz, o más específicamente toda la radiación electromagnética, puede ser dividida en un número finito de "cuantos de energía", que son localizados como puntos en el espacio. De la introducción del paper de cuántica On a heuristic viewpoint concerning the emission and transformation of light (Un punto de vista heurístico relacionado con la emisión y transformación de la luz) de marzo de 1905:
"De acuerdo a las suposiciones a ser contempladas aquí, cuando un rayo de luz se está propagando desde un punto, la energía no está distribuida continuamente sobre espacios cada vez más grandes, pero está constituida de un número finito de cuantos de energía que son localizados en puntos en el espacio, moviéndose sin dividirse y pudiendo ser absorbidos o generados sólo en su conjunto."
Albert Einstein
El modelo cuántico del átomo de Niels Bohr desarrollado en 1913, el cual incorporó una explicación a la fórmula de Johannes Rydberg de 1888; la hipótesis cuántica de Max Planck de 1900, esto es, que los radiadores de energía atómica tienen valores de energía discreta ( ); el modelo de J. J. Thomson en 1904, el postulado de luz cuántica de Albert Einstein en 1905 y el descubrimiento en 1907 del núcleo atómico positivo hecho por Ernest Rutherford.
); el modelo de J. J. Thomson en 1904, el postulado de luz cuántica de Albert Einstein en 1905 y el descubrimiento en 1907 del núcleo atómico positivo hecho por Ernest Rutherford.
 ); el modelo de J. J. Thomson en 1904, el postulado de luz cuántica de Albert Einstein en 1905 y el descubrimiento en 1907 del núcleo atómico positivo hecho por Ernest Rutherford.
); el modelo de J. J. Thomson en 1904, el postulado de luz cuántica de Albert Einstein en 1905 y el descubrimiento en 1907 del núcleo atómico positivo hecho por Ernest Rutherford.| Fecha | Persona | Contribución |
| 1771 | Luigi Galvani | Notó que los músculos de las ranas muertas se movían ligeramente cuando los golpeaba con un descargador eléctrico, a lo que se refirió como "electricidad animal". |
| 1800 | Alessandro Volta | Inventó la pila voltaica o batería, específicamente para refutar la teoría de la electricidad animal de Galvani. |
| 1838 | Michael Faraday | Usando la batería de Volta descubrió los rayos catódicos cuando, durante un experimento pasó corriente a través de un tubo de vidrio lleno de un aire enrarecido y notó un extraño arco de luz comenzando en el ánodo (electrodo positivo) y finalizando en el cátodo (electrodo negativo). |
| 1852 | Edward Frankland | Inició la teoría de valencia, proponiendo que cada elemento fuese una específica "combinación de poder". Por ejemplo, algunos elementos como el nitrógeno tienden a combinarse con otros tres elementos (e.g. NO3), mientras que otros podrían tender a combinarse con cinco (PO5), y que cada elemento que se esfuerza por cumplir con su cuota de combinación de poder (valencia) para así satisfacer sus afinidades. |
| 1859 | Gustav Kirchhoff | Declaró el "problema del cuerpo negro": ¿cómo la intensidad de la radiación electromagnética emitida por un cuerpo negro depende de la frecuencia de la radiación y de la temperatura del cuerpo? |
| 1877 | Ludwig Boltzmann | Sugirió que los estados de energía de un sistema físico deberían ser discretos. |
| 1879 | William Crookes | Mostró que los rayos catódicos (1938), a diferencia de los rayos de luz, pueden ser doblados en un campo magnético. |
| 1885 | Johann Jakob Balmer | Descubrió que las cuatro líneas visibles del espectro del hidrógeno podían ser asignadas enteras a una serie. |
| 1888 | Johannes Rydberg | Modificó la fórmula de Balmer para incluir las otras series de líneas y producir la fórmula de Rydberg. |
| 1891 | Alfred Werner | Propuso una teoría de afinidad y valencia en la cual la afinidad es una emisión de fuerza atractiva del centro del átomo la cual actúa uniformemente desde allí hacia todas las partes de la superficie esférica del átomo central. |
| 1892 | Heinrich Rudolf Hertz | Mostró que los rayos catódicos (1838) podían pasar a través de hojas delgadas de láminas de oro y producir una apreciable luminosidad de los cristales detrás de ellos. |
| 1896 | Henri Becquerel | Descubrió la "radiactividad", un proceso en el cual, debido a la desintegración nuclear, ciertos elementos o isótopos espontáneamente emiten uno de las tres entidades energéticas: partículas alfa (carga positiva), partículas beta (carga negativa) y partículas gama (carga neutral). |
| 1897 | Joseph John Thomson | Mostró que los rayos catódicos (1838) se curvan bajo la influencia de un campo eléctrico y un campo magnético y para explicar esto el sugirió que los rayos catódicos están negativamente cargados de partículas eléctricas subatómicas o corpúsculos" (electrones), sacados del átomo; y en 1904 propuso el modelo del "budín de ciruela, en el cual los átomos tienen una masa amorfa (budín) positivamente cargada como un cuerpo empotrado con electrones negativamente cargados (ciruelas) dispersos en su totalidad en la forma de anillos rotando de manera no aleatoria. |
| 1900 | Max Planck | Para explicar la radiación de cuerpo negro, sugirió que la energía electromagnética podría ser emitida sólo en forma cuantizada, esto es, la energía sólo podría ser un múltiplo de una unidad elemental de E = hf, donde h es la constante de Planck y f la frecuencia de la radiación. |
| 1902 | Gilbert N. Lewis | Para explicar la regla del octeto (1893), desarrolló el modelo del átomo cúbico, en el cual los electrones estaban ubicados en los vértices de un cubo y sugirió que los enlaces simples, dobles y triples se dan cuando dos átomos se mantienen unidos por múltiples pares de electrones (un par por cada enlace) entre ambos átomos (1916). |
| 1904 | Richard Abegg | Notó la existencia de un patrón en la diferencia numérica entre la máxima valencia positiva de un elemento, como +6 para H2SO4, y su máxima valencia negativa, como -2 para H2S, que tiende a ser de ocho (regla de Abegg). |
| 1905 | Albert Einstein | Para explicar el efecto fotoeléctrico, es decir, la emisión de electrones por un material cuando se le ilumina con radiación electromagnética, postuló que la luz está formada por partículas cuánticas individuales (fotones), basándose en la hipótesis cuántica de Planck (1900). |
| 1907 | Ernest Rutherford | Para testear el modelo del budín de ciruelas (1904), él disparó partículas alfa (positivamente cargadas) en una lámina de oro y notó que algunos se devolvían, lo cual demuestra que los átomos tienen un pequeño núcleo atómico cargado positivamente en su centro. |
| 1913 | Niels Bohr | Para explicar la fórmula de Rydberg (1888), la cual modela correctamente el espectro de la emisión de luz al modela correctamente el espectro de la emisión de luz del átomo de hidrógeno, postuló la hipótesis sobre que los electrones cargados negativamente giran en torno a un núcleo postivamente cargado en ciertas distancias "cuánticas" fijas, y que cada uno de estas "órbitas esféricas" tienen una energía específica asociada de tal manera que los movimientos de electrones entre las órbitas requiere emisiones "cuánticas" o absorciones de energía. |
no entendo ._.
ResponderEliminarno entendo ._.
ResponderEliminargjhbjnm,km.l ._.
ResponderEliminargjhbjnm,km.l ._.
ResponderEliminarya veo ahora mi duda a sido aclarada gracias :)
ResponderEliminarya veo ahora mi duda a sido aclarada gracias :)
ResponderEliminarQue bien :)
ResponderEliminarohh
ResponderEliminartu culo
ResponderEliminarQuien propido la tabla periódica cuantica?
ResponderEliminarquien quiere regalarme su virginidad!!! :D [^0^]
ResponderEliminarI don't know
ResponderEliminarGRACIAS :3
ResponderEliminarME SALVARON MUSHOOOOO
ResponderEliminarel maldo es gay
ResponderEliminarPao tiene la voz sexy
ResponderEliminar